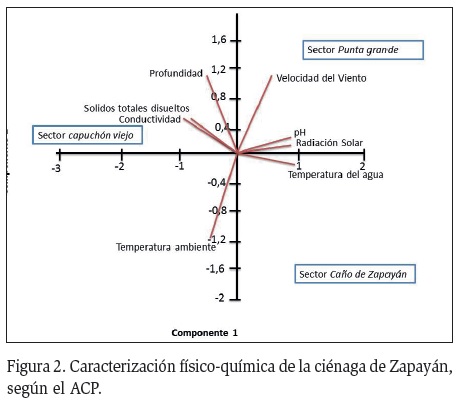
El Análisis de Componentes Principales (ACP), en los dos primeros componentes acumuló más del 90 % de la varianza (Figura 2). Variables tales como conductividad, Sólidos Totales Disueltos (STD) y en menor proporción la profundidad, favorecieron la presencia de los macroinvertebrados en el sector Capuchón Viejo. En Punta Grande, los valores de pH (promedio: 8,4 unidades), la radiación solar alta y la velocidad del viento alta (2,5 m/s) favorecieron y caracterizaron este sector, lo cual se relaciona en este trabajo con el incremento de los macroinvertebrados. En el sector del Caño Zapayán, los bajos valores de la profundidad, la conductividad y los STD coincidieron con la baja abundancia de los organismos.
Composición de macroinvertebrados
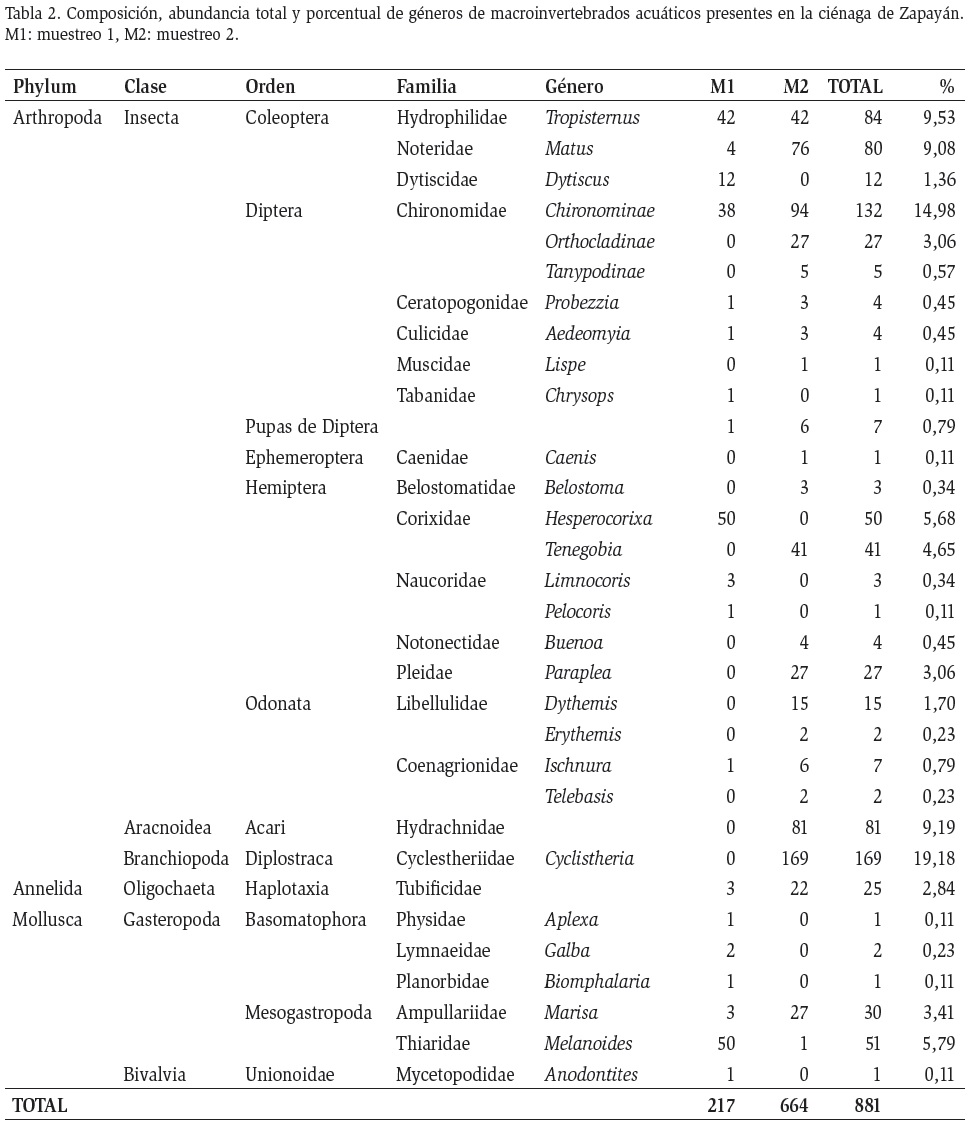
En general se recolectaron 881 individuos, de los cuales el 75,37 %, se recolectaron en el segundo muestreo y el 24,63 % en el primer muestreo. La composición estuvo representada por 27 géneros en el primer muestreo y 33 en el segundo. Para ambos muestreos, la familia Cyclestheriidae (Branchiopoda: Spinicaudata), fue la más abundante con 19,18 %, seguida de Chironomidae (Insecta: Diptera) con 14,98 %. Las familias con las menores abundancias fueron Muscidae, Tabanidae (Diptera), Ceanidae (Ephemeroptera), con solo el 0,11 % equivalente a solo un organismo en cada caso (Tabla 2).
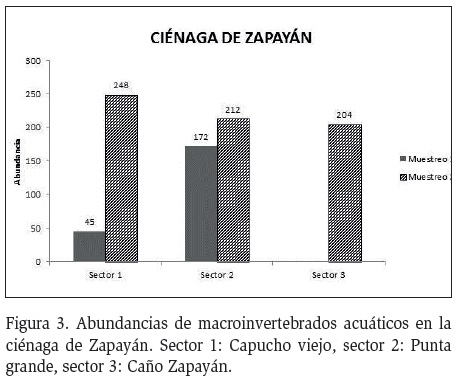
De manera general, el sector con mayor abundancia fue Punta Grande con 384 individuos. Para el primer muestreo las bajas abundancias (45 ind.) se obtuvieron en el sector Caño de Zapayán, al igual que las mayores abundancias durante el muestreo dos (248 ind., Figura 3). Diptera y Hemiptera, presentaron el mayor número de familias durante todo el estudio (cinco cada uno), seguidos por Coleoptera y Basomatophora con tres familias respectivamente. Los Órdenes Ephemeroptera, Acari, Diplostraca, Haplotaxia y Unionoida, mostraron la menor riqueza de familias con una en cada caso. Las familias Dytiscidae (Coleoptera), Tabanidae y Naucoridae, solo se registraron en el primer muestreo, mientras que Muscidae, Ceanidae Belostomatidae, Notonectidae, Pleidae, Libellulidae, Hydrachnidae y Cyclesthriidae fueron exclusivas del segundo muestreo (Tabla 2).
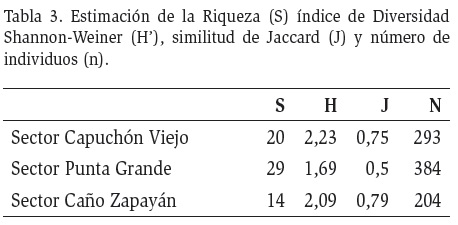
El sector con la diversidad más alta, según el índice de Shannon- Weiner, fue Punta Grande donde se registraron 29 géneros, con una similitud entre sí del 0,5 y un total de 384 individuos recolectados. Por otro lado, el Caño de Zapayán presentó la menor riqueza a nivel de géneros (Tabla 3).
DISCUSIÓN
En la ciénaga de Zapayán no se evidenciaron variaciones relacionadas con las variables fisicoquímicas durante los muestreos. Sin embargo, los altos valores de conductividad que se registraron en el sector de Capuchón Viejo, puede deberse a la gran cantidad de STD, los cuales registraron los mayores valores. No obstante, todos los sectores evaluados fueron similares: Poca vegetación ribereña y zonas extensas de pastizales para el pastoreo de ganado.
La abundancia registrada de macroinvertebrados acuáticos en la ciénaga, se debe probablemente a la disponibilidad de alimento y de refugio ofertado por las raíces de macrófitas flotantes. Sin embargo, la cobertura
de estás plantas es reducida debido a la poca dispersión dentro del sistema. En comparación con trabajos de sistemas similares, Deluque et al. (2006) en la ciénaga de Cerro de San Antonio, registraron 296 individuos, de 20 familia y ocho órdenes; mientras que en este estudio se registraron 881 organismos, de 25 familias y 11 órdenes. Adicionalmente, 31 morfotipos fueron identificados hasta el nivel de género.
La alta abundancia del Orden Brachiopoda, se debe a la capacidad adaptativa que posee a los cambios en el ambiente y a su amplio rango de tolerancia a cierto grado de contaminación. Los ordenes Diptera y Hemiptera, son los que poseen la mayor riqueza de familias y géneros en la ciénaga. De manera general son muy numerosos en ambientes lénticos y entre la vegetación litoral, quizá por la capacidad de sus taxones de adaptarse a múltiples ambientes y desarrollar diferentes estrategias de alimentación (Mosquera et al., 2008). Este hecho los hace grupos importantes en las cadenas tróficas, principalmente como fuente de alimento de peces, anfibios y de otras especies se alimentan de algas o de detrito orgánico (Archangelsky, 2001). Otras razones que explican la alta diversidad de estos organismos, está dada por la tolerancia a las altas temperaturas, bajas concentraciones de oxígeno y altas concentraciones de materia orgánica.
La Clase Insecta aportó en mayor medida a la composición de macroinvertebrados acuáticos en la ciénaga de Zapayán, al igual que la familia Cyclestheriidae (Crustacea: Branchiopoda: Spinicaudata), que fue la más abundante con 19,18 %, lo cual coincide con lo registrado por Martínez y Pinilla (2014), quienes encontraron la dominancias de las familias Cyclestheriidae, Hydrophilidae, Dysticidade, Chironomidae en la macrofauna asociada a raíces de Eichhornia crassipes en ciénagas del departamento del Cesar. La predominancia de estos crustáceos branquiópodos (Cyclestheriidae), dípteros (Chironomidae), generalmente se han explicado por la presencia de cantidades importantes de materia orgánica en el sistema (Pinilla, 2000), mientras que familias como Hydrophilidae y Dysticidae, principalmente depredadores (Pérez et al. 2004), dan indicios de una abundante oferta alimenticia (Martínez y Pinilla, 2014).
El índice de diversidad evaluado registró valores de 2,23, para el sector de Capuchón Viejo (Tabla 3), esto puede indicar que las condiciones estructurales y ecológicas de este sector, permiten el desarrollo de la fauna acuática. En la ciénaga de Zapayán se evidencian, las características propias de las zonas bajas de los ríos y los planos de inundación costeros, presentando diversidades bajas. Los valores de la similitud de Jaccard evidencian poca variación en la composición a nivel de género entre las estaciones. Este hecho puede obedecer a que en todas las estaciones se presentan condiciones similares, las cuales son importantes para la estructuración de las comunidades de macroinvertebrados acuáticos (Castellanos y Serrato, 2008).
Dystiscus (Coleoptera), Crysops (Diptera), Galba, Aplexa y Biomphalaria (Basomatophora), fueron exclusivos del primer muestreo, su ausencia en el segundo muestreo, puede estar asociado al proceso de contaminación antrópica evidenciado en la ciénaga. Sin embargo, Mosquera et al. (2008), indican que grupos como Coleoptera, Ephemeroptera y Hemiptera, son tolerantes a los cambios que se puedan dar en la ciénaga, lo que puede conllevar a la desaparición de algunos org anismos que prefieren aguas limpias y favorecer la reproducción de especies tolerantes (ej. Chironomidae), a las aguas contaminadas.
CONCLUSIÓN
Los artrópodos presentaron la mayor riqueza y composición en todas las estaciones muestreadas en la ciénaga de Zapayán. La Clase Insecta fue la representativa en términos de abundancia. Las bajas abundancias de macroinvertebrados puede deberse principalmente a la baja oferta alimenticia y altas temperaturas del agua.
La ciénaga de Zapayán es un sistema acuático que de acuerdo a la bibliografía, posee abundante materia orgánica en descomposición, posiblemente con baja productividad primaria y contenido moderado de nutrientes. Sin embargo, es fundamental la realización de estudios más complejos donde se haga un monitoreo a otras variables físicas y químicas y nutrientes, así como la productividad del sistema.
AGRADECIMIENTOS
La presente investigación hace parte del proyecto “Investigación Para La Caracterización, Zonificación, Ordenamiento, Restauración Y Manejo De Las Ciénagas Del Departamento Del Magdalena”. BPIN: 2013000100017, financiado con recursos del Fondo de Ciencia y Tecnología del Sistema General de Regalías.
BIBLIOGRAFÍA
Archangelsky, M. 2001. Coleóptera. En: Fernández y Domínguez (Eds). Guía para la determinación de artrópodos bentónicos sudamericanos. Editorial Universitaria de Tucumán, Argentina.
Arias, P. 1985. Las ciénagas en Colombia. Revista Divulgación Pesquera Inderena 22: 39-70.
Bayona-Arenas, M.R. y Rueda, G. 2008. Caracterización de la fauna asociada a raíces de Eichhornia crassipes (Mart) SolmsLaubach 1883 en diferentes provincias limnológicas de Colombia. VIII Seminario Colombiano de Limnología. Cali.
Bouchard, R.W., Jr. 2004. Guide to aquatic macroinvertebrates of the Upper midwest. Water Resources center, University of Minnesota, St. Pau, MN.
Castellanos, P. y Serrato C. 2008. Diversidad de macroinvertebrados acuáticos en un nacimiento de río en el páramo de Santurbán, Norte de Santander. Revista Academia Colombiana de Ciencias 32(122): 79-86.
Deluque, J., Reyes, S., Sierra, T., y López, W. 2006. Primeros reportes de familias de macroinvertebrados asociados a las macrófitas acuáticas en la ciénaga del Cerro de San Antonio (Río Magdalena, Colombia). Revista Intrópica 2: 77-86.
Domínguez, E. y Fernández, R. (Eds.) 2009. Macroinvertebrados Bentónicos Sudamericanos. Sistemática y Biología. Fundación Miguel Lillo, Tucumán, Argentina.
Duarted, J., Capadorr, R. y Rincón, M.E. 2008. Entomofauna acuática asociada a Paspalum repens en los lagos I y IV del sistema lagunar Yahuarcaca (Leticia Amazonas). VIII Seminario Nacional de Limnología. Santiago de Cali.
Escobar, C. 2005. Taxonomía y Notas Ecológicas de la Hemípterofauna Acuática del Rio Gaíra Sierra Nevada de Santa Marta (Magdalena, Colombia). Tesis de Pregrado. Facultad de Ciencias Básicas. Universidad del Magdalena, Santa Marta, Colombia.
Estrada, A. 2013. Diagnóstico de la biodiversidad de los macroinvertebrados en cuatro sistemas lénticos de Zamorano. Tesis de grado en ingeniería de ambiente y desarrollo. Escuela Agrícola Panamericana. Zamorano. Honduras.
Heckman, C.W. 2011. Encyclopedia of south American aquatic insects. Ediciones Springer. Olympia Washington, USA.
Hellawell, J.M. 1978. Biological surveillance of river. Water Research Centre, Stevenage and Memenhan, England.
Herrera-Zambrano, E. y Rueda-Salgado, G. 2008. Macroinvertebrados asociados a raíces de Echhornia crassipes (Pontederiaceae), en ciénagas del Caribe colombiano. VIII Seminario Colombiano de Limnología. Santiago de Cali.
Junk, W. y Wantzen, K. 2004. The flood pulse concept: New aspects, approaches and applications – An upate. En: Welcomme, R.L. y Petr, T. (Ed). Proceedings of the second international symposium on the management of large rivers for fisheries. Vol. 2. Food and Agricultural Organization y Mekong River Commision. FAO Regional Office for Asia and Pacific, Bangkok.
Martínez, M. y Pinilla, G. 2014. Valoracion de la calidad del agua de tres ciénagas del departamento de cesar mediante macroinvertebrados asociados a Eichhornia crassipes (Pontederiaceae). Caldasia 36(2): 305-321.
Merritt, R. y Cummins, K. 1996. An Introduction to the Aquatic Insects of North America. Iowa. USA. Kendall-Hunt Publishing Company.
Moreno, L. y Fonseca, C. 1987. Ciénagas: Polos potenciales para el desarrollo. Actualidades Biológicas 16(60): 57-68.
Moreno, L., García, L.C. y Márquez, G. 1987. Productividad e importancia del bosque ripario del complejo de Ciénagas de Chucurí (Departamento de Santander, Colombia). Actualidades Biológicas 16(61): 93–102.
Mosquera, D.R., Palacios, M.L., Muñoz, E., Soto, A y Peña, E.J. 2008. Diversidad de los macroinvertebrados de
la laguna de Sonso, Valle del Cauca, Colombia. Revista de Ciencias 12: 45- 56
Pérez, R., Pineda, R. y Campos, V. 2004. Estructura trófica de las asociaciones de macroinvertebrados acuáticos de manantiales cársticos en la Huasteca Mexicana. Biológicas 6: 37-47.
Pinilla, G. 2000. Indicadores biológicos en ecosistemas acuáticos continentales de Colombia. Compilación bibliográfica. Fundación Universidad de Bogotá Jorge Tadeo Lozano. Centro de Investigaciones Científicas. Bogotá.
Poi de Neiff, A., Canón-Verón, M.B. y Frutos, S.M. 1998. Relaciones Tróficas entre Peces, Macroinvertebrados y Zooplancton en una Laguna Eutrófica. (Corrientes, Argentina). Centro de Ecología Aplicada del Litoral (CECOAL). Corrientes - Argentina. C.C. 291 - (3400)
Quirós, J., Dueñas, P., Y Ballesteros, J. 2010. Macroinvertebrados Asociados a Raices de Ecchornia crassipes (Mart). Solms, En Dos Sectores Del Complejo Cenagoso Del Bajo Sinú, Departamento Del Córdoba, Colombia. Revista Asociación Colombiana de Ciencias. 22: 147-157.
Ruiz-Moreno, J., Ospina, R. y Riss, W. 2000. Guia para la identificación genérica de larvas de quironomidos (Diptera: Chironomidae) de la sabana de Bogota. II. Subfamilia Chironominae. Caldasia 22(1): 15-33.
Yuka, S.G. 1996. Métodos de amostragen de macroinvertebrados bentónicos para el monitoreo biológico. Memorias seminario Internacional de Macroinvertebrados Acuáticos. Cali, Colombia.
Fecha de recepción: 14/08/2015
Fecha de aceptación: 18/11/2015
Para citar este artículo: Rúa-García, G. 2015. Macroinvertebrados acuáticos asociados a raíces de Eichhornia crassipes (MART) Solms en la ciénaga de Zapayán, Colombia. Revista Intropica Vol. 10: 52 - 59